المحاضره الرابعه / خليه دانيال / قطب الهيدروجين القياسي
الكيمياء الكهربائية: خلية دانيال وقطب الهيدروجين القياسي
مقدمة:
الكيمياء الكهربائية تهتم بدراسة العلاقة بين الكهرباء والتفاعلات الكيميائية، خاصة تلك التي تعتمد على انتقال الإلكترونات، وتعرف باسم تفاعلات الأكسدة والاختزال (Redox). لفهم هذه التفاعلات عمليًا، ندرس أجهزة بسيطة مثل خلية دانيال وقطب الهيدروجين القياسي.
أولًا: خلية دانيال (Daniel Cell)
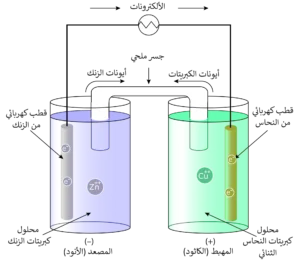
تعريفها:
خلية دانيال هي خلية جلفانية تُحوّل الطاقة الكيميائية إلى كهربائية من خلال تفاعل تلقائي بين الزنك والنحاس.
تركيب خلية دانيال:
- قطب الزنك (الأنود):
- قضيب من الزنك يوضع في محلول يحتوي على
مثل كبريتات الزنك
.
- يحدث فيه تفاعل الأكسدة:
- قضيب من الزنك يوضع في محلول يحتوي على
- قطب النحاس (الكاثود):
- قضيب من النحاس يوضع في محلول يحتوي على
مثل كبريتات النحاس
.
- يحدث فيه تفاعل الاختزال:
- قضيب من النحاس يوضع في محلول يحتوي على
- السلك الموصل:
- يوصل بين القطبين وتمر من خلاله الإلكترونات من الأنود إلى الكاثود.
- قنطرة ملحية (Salt Bridge):
- أنبوب يحتوي على محلول إلكتروليتي (مثل NaNO₃ أو KCl) يسمح بمرور الأيونات لتعادل الشحنات، ومنع تراكمها في أي نصف خلية.
- تحافظ على الاتزان الكهربائي في الخلية.
مخطط خلية دانيال:
- الخط المفرد (|): يمثل الفاصل بين الطور الصلب والمحلول.
- الخط المزدوج (||): يمثل القنطرة الملحية.
الجهد الكهربائي للخلية:
يُحسب من الفرق بين جهد الكاثود والأنود:
في خلية دانيال:
- جهد اختزال النحاس = +0.34 فولت
- جهد اختزال الزنك = –0.76 فولت
الملاحظات:
- الإلكترونات تسير من الزنك (الأنود) إلى النحاس (الكاثود).
- الزنك يتآكل مع الزمن لأنه يتأكسد.
- النحاس يزداد سمكه لأن أيونات Cu²⁺ تُختزل وتترسب على القطب.
ثانيًا: قطب الهيدروجين القياسي (Standard Hydrogen Electrode – SHE)
تعريفه:
هو القطب المرجعي العالمي الذي يُستخدم لقياس جهود الأقطاب الأخرى. يُعرّف بأن جهده = صفر فولت في الظروف القياسية.
تركيبه:
- غاز الهيدروجين (H₂):
- يُمرر بضغط 1 atm فوق محلول حمضي (عادة حمض الهيدروكلوريك HCl بتركيز 1M).
- قطب البلاتين (Pt):
- قضيب من البلاتين غير نشط، يُستخدم كموصل للإلكترونات ويُغطى بجزيئات بلاتين سوداء لزيادة المساحة السطحية.
- البيئة:
- درجة الحرارة = 25°C (298 K).
- الضغط = 1 atm.
- تركيز الأيونات الهيدروجينية (H⁺) = 1 M.
معادلة نصف التفاعل عند القطب:
- إذا كان القطب الآخر أقوى في الاختزال، فإن الهيدروجين سيتأكسد.
- إذا كان القطب الآخر أضعف، فإن الهيدروجين سيتحول إلى أيونات (يختزل الآخر).
أهمية قطب الهيدروجين القياسي:
- يُستخدم كمرجع لتحديد جهد الاختزال القياسي لأي عنصر.
- لا يمكن قياس جهد قطب بمفرده، لذا نربطه دائمًا بقطب الهيدروجين في خلية جلفانية.
- إذا أعطى القطب الآخر جهدًا موجبًا عند الاتصال بالهيدروجين، فهو أقوى اختزالًا من H⁺.
- إذا أعطى جهدًا سالبًا، فهو أضعف.
ثالثًا: حساب جهد الخلية باستخدام قطب الهيدروجين
مثال:
نريد معرفة جهد اختزال الزنك باستخدام قطب الهيدروجين.
نربط خلية كالآتي:
- إذا كان الجهد الناتج = –0.76 فولت، فإن:
سلسلة الجهود القياسية (Electrochemical Series):
قائمة تحتوي على جهود اختزال عناصر عديدة، مرتبة من الأعلى (أقوى مواد اختزالًا) إلى الأسفل (أضعفها).
- الأعلى جهدًا: عناصر تُختزل بسهولة (مثل F₂، Au³⁺، Cl₂)
- الأقل جهدًا: عناصر تتأكسد بسهولة (مثل Zn، Mg، Na)
رابعًا: مقارنة بين خلية دانيال وقطب الهيدروجين القياسي
| العنصر | خلية دانيال | قطب الهيدروجين القياسي |
|---|---|---|
| نوع الخلية | جلفانية | مرجعية |
| الغرض | توليد تيار من تفاعل Zn و Cu | قياس جهود الأقطاب |
| الجهد | 1.10 فولت | 0.00 فولت |
| التفاعل في الأنود | Zn → Zn²⁺ + 2e⁻ | H₂ → 2H⁺ + 2e⁻ (إذا عمل كأنود) |
| المكون المعدني | الزنك والنحاس | بلاتين |
| استخدام القنطرة الملحية | نعم | نعم |
خاتمة:
خلية دانيال وقطب الهيدروجين القياسي من الركائز الأساسية لفهم الكيمياء الكهربائية. خلية دانيال تُظهر كيفية توليد التيار من تفاعلات الأكسدة والاختزال، بينما قطب الهيدروجين هو الأساس المرجعي لجميع قياسات جهود الأقطاب. فهم تركيبهما، وآلية عملهما، وطريقة الربط بينهما، يُكسب الطالب قدرة على تحليل التفاعلات الكهروكيميائية وفهم تطبيقاتها العملية مثل البطاريات والتحليل الكهربائي.
