R-X المحاضره الثانيه / هاليد الالكيل
مقدمة
هاليدات الألكيل (Alkyl Halides) أو ما تُعرف أيضًا باسم الهاليدات العضوية هي مركبات عضوية تحتوي على مجموعة ألكيل (R) مرتبطة مباشرة بذرة من الهالوجينات (X) مثل: الفلور (F)، الكلور (Cl)، البروم (Br)، أو اليود (I).
تُعد هذه المركبات وسيطة مهمة في التفاعلات الكيميائية، وتستخدم على نطاق واسع في الصناعات الدوائية والبتروكيميائية.
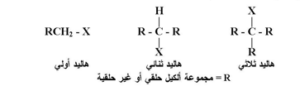
التركيب العام لهاليدات الألكيل
الصيغة العامة لهاليدات الألكيل هي:
حيث:
- R = مجموعة ألكيل مشتقة من ألكان (مثل: CH₃–، C₂H₅–…)
- X = ذرة هالوجين (F, Cl, Br, I)
مثال:
كلور الميثيل → CH₃Cl
بروم الإيثيل → C₂H₅Br
تصنيف هاليدات الألكيل
تُصنّف هاليدات الألكيل بعدة طرق:
1. حسب نوع الكربون المرتبط بالهالوجين:
- أولية (1°): إذا كانت ذرة الكربون المرتبطة بالهالوجين مرتبطة بذرة كربون واحدة فقط.
- مثال: CH₃CH₂Cl (كلور الإيثيل)
- ثانوية (2°): إذا كانت ذرة الكربون مرتبطة بذرتي كربون.
- مثال: CH₃CHClCH₃ (كلور البروبان-2)
- ثالثية (3°): إذا كانت ذرة الكربون مرتبطة بثلاث ذرات كربون.
- مثال: (CH₃)₃CCl (كلور التيرت-بيوتيل)
2. حسب عدد ذرات الهالوجين:
- أحاديات الهالوجين: تحتوي على ذرة هالوجين واحدة.
- متعددة الهالوجين: تحتوي على أكثر من ذرة هالوجين (مثل CHCl₃ – كلوروفورم).
طرق تحضير هاليدات الألكيل
هناك عدة طرق لتحضير هاليدات الألكيل في المختبر:
1. من الكحولات (Alcohols):
أشهر الطرق، ويتم فيها استبدال مجموعة الهيدروكسيل –OH بذرة هالوجين X باستخدام عوامل هالوجنة مثل:
- HCl أو HBr
- PCl₃، PCl₅
- SOCl₂ (ثيونيل كلوريد)
مثال:
CH₃CH₂OH + HBr → CH₃CH₂Br + H₂O
2. من الألكينات (Alkenes):
عن طريق تفاعل الإضافة الهيدروهالوجينية (Hydrohalogenation):
CH₂=CH₂ + HBr → CH₃CH₂Br
3. من الهالوجينات المباشرة:
يتم تفاعل الألكانات مع الهالوجينات (مثل Cl₂) في وجود الضوء أو الحرارة:
CH₄ + Cl₂ → CH₃Cl + HCl
(تفاعل استبدال ضوئي)
الخواص الفيزيائية لهاليدات الألكيل
- الحالة الفيزيائية:
- المركبات ذات الكتلة الجزيئية الصغيرة تكون غازات أو سوائل (مثل CH₃Cl).
- المركبات الأعلى تكون سوائل أو مواد صلبة.
- درجة الغليان:
أعلى من الألكانات المناظرة بسبب القطبية. - الذوبانية:
لا تذوب في الماء، ولكنها تذوب في المذيبات العضوية مثل الإيثر، البنزين. - الرائحة:
بعضها له رائحة مميزة وقوية، وأحيانًا خانقة (مثل الكلوروفورم).
الخواص الكيميائية لهاليدات الألكيل
1. تفاعلات الاستبدال (Substitution):
يُعد هذا من أهم التفاعلات، حيث يتم استبدال ذرة الهالوجين بمجموعة أخرى.
مثال:
CH₃CH₂Br + OH⁻ → CH₃CH₂OH + Br⁻
(تكوين الكحول)
أو
CH₃CH₂Cl + NH₃ → CH₃CH₂NH₂ + HCl
(تكوين أمين)
نوع التفاعل قد يكون:
- SN1: استبدال أحادي الجزيء – يحدث في الهاليدات الثالثية.
- SN2: استبدال ثنائي الجزيء – يحدث في الهاليدات الأولية.
2. تفاعلات الحذف (Elimination):
يحدث عند تسخين هاليد الألكيل مع قاعدة قوية، مما يؤدي إلى تكوين ألكين:
CH₃CH₂Br + KOH (كحول) → CH₂=CH₂ + KBr + H₂O
3. تفاعلات مع المغنيسيوم (تكوين كاشف غرينيار):
R–X + Mg → R–Mg–X
(يُستخدم في تفاعلات تركيبية عديدة)
مثال:
CH₃Br + Mg → CH₃MgBr
أهمية هاليدات الألكيل
تُستخدم هاليدات الألكيل على نطاق واسع في المجالات التالية:
- الدواء: تدخل في صناعة المسكنات والمضادات الحيوية.
- المبيدات: تُستخدم في تصنيع المبيدات الحشرية.
- المذيبات: مثل الكلوروفورم، رباعي كلوريد الكربون.
- كواشف عضوية: في التفاعلات التركيبية.
- البتروكيمياويات: كمادة أولية لتحضير مركبات أكثر تعقيدًا.
تأثير الهالوجين على النشاط الكيميائي
تؤثر طبيعة ذرة الهالوجين على نشاط هاليد الألكيل:
- كلما زاد حجم الهالوجين (من F إلى I)، كلما كانت رابطة C–X أضعف، وبالتالي يسهل كسرها.
- لذلك، هاليدات اليود أكثر تفاعلية من البروم، ثم الكلور، ثم الفلور.
السمية والبيئة
بعض هاليدات الألكيل تعتبر ضارة وسامة، وقد تؤثر على البيئة وصحة الإنسان:
- رابع كلوريد الكربون (CCl₄): سام للكبد.
- الكلوروفورم (CHCl₃): مادة مخدّرة ولكنها ملوثة ومسرطنة.
- بعض الهاليدات تُساهم في ثقب الأوزون (مثل مركبات CFCs).
لذا، يتم استبدال بعض هذه المركبات ببدائل أكثر أمانًا بيئيًا.
خاتمة
هاليدات الألكيل R–X تمثّل فئة محورية في الكيمياء العضوية، إذ إنها جسور تربط المركبات البسيطة بالمركبات المعقدة من خلال تفاعلات استبدال أو حذف أو تكوين مركبات جديدة مثل كواشف غرينيار. فهم طبيعتها الكيميائية وبنيتها يسهم في توسيع أفق الطالب في الكيمياء، ويمكّنه من متابعة التفاعلات العضوية بشكل أعمق وأكثر دقة.
